exemple:
l'huile dans le vinaigre si l'on veut redistribuer il est nécessaire de fournir l'énergie mécanique par agitation.
1- tension superficielle:
Une
molécule liquide repos est soumise à des forces d'attractions que les
molécules voisin exercent sur elle. La molécule A est soumise à des
forces symétriques qui s'équilibre, par contre la molécule B à la
surface libre n'est plus soumise à des forces symétriques, puisque elle
est entouré des molécules de nature déférent.
La
molécule B est attiré en moyen vers l’intérieur, ce qui manifeste par
une tendance des liquides à réduite leur surface libre: forme sphérique
des petits goutes de liquide.
Une augmentation de surface ds nécessite une consommation d'énergie extérieur:
2- Contact d'un liquide avec un solide et un gaz:
Un corps trompé dans un liquide peut en sortir muez où sec.
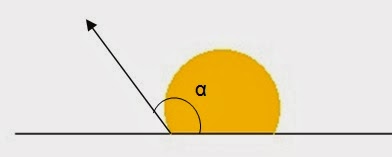
* Angle de contact alpha α:
considérons
l'équilibre d'une goute posé sur la surface horizontal d'un solide . il
existe trois phase, donc trois interfaces: gaz / liquide , gaz / solide , liquide / solide .
l’équilibre au point M s'écrit:
La somme des forces en projection (x'x) s'écrit:
On trouve finalement l'angle α:

mouillage parfait

exemple:mercure sur verre propre
Applications:
* α=0 : mouillage fort, étalement du liquide .
pour
entretien les tissus en incorporant des substances tensioactives dans
les lessives pour diminuer le coefficient de tension superficielle de
l'eau δ . On diminue le mouillage des produits pétroliers qui se diverse
accidentellement sur la mère.
* α= π/2: mouillage faible: fabrication des tissus imprenable .
Si vous avez des questions merci de laisser un commentaire ...







Aucun commentaire:
Enregistrer un commentaire